NEVTRALISERING O G PH-VIR‹I
77
Við tað at aðrar jonir enn H
+
og OH
–
eisini eru í
løgnum, tá ið vit blanda sýru og basu saman,
kunnu eisini aðrar tilgongdir fara fram. Tað fara
vit at kanna í næstu felagsroynd.
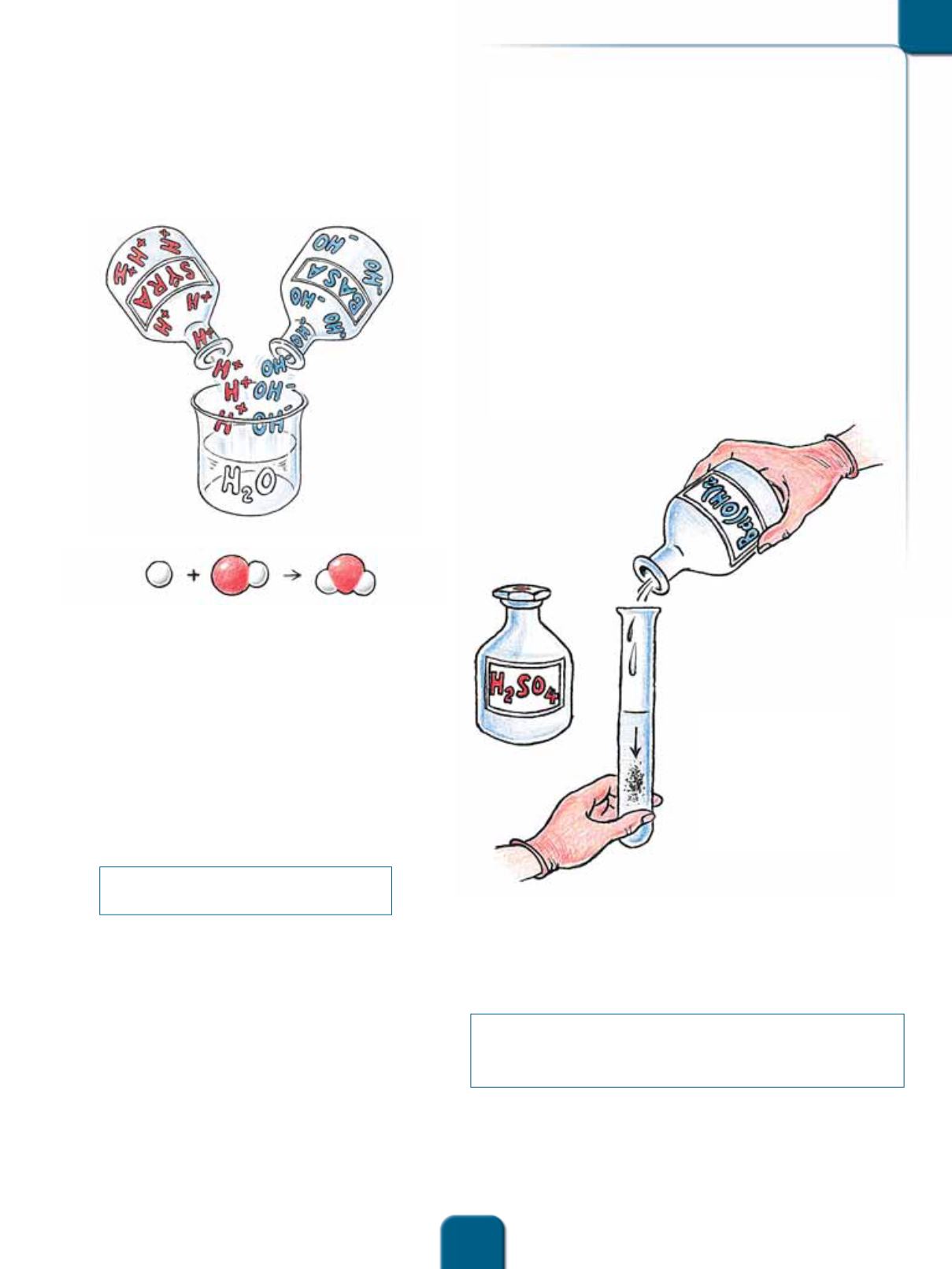
Felagsroynd. At blanda sýru og basu
Eitt sindur av tyntari svávulsýru H
2
SO
4
verður
latið í eitt royndarglas. So stoyta vit eitt sindur av
basuni barium-hydroxid Ba(OH)
2
í glasið.
Tað sæst beinanvegin, at grugg kemur í glasið.
Úrskilt verður eitt fast evni, sum legst á botn, tá
ið glasið stendur.
Royndin vísir, at nevtraliseringin umframt vatn
gevur eitt eitt fast evni. Skriva vit upp basu og
sýru sum jonir, kunnu vit skilja tað, sum hendir:
Fasta evnið, sum verður gjørt, er salt, sum verður
nevnt bariumsulfat BaSO
4
.
Hydrogen-jonir og hydroxid-jonir í løgnum
verða til vatnmýl.
Ba
2+
+ 2 OH
–
+ 2 H
+
+ SO
4
2–
→
2 H
2
O + BaSO
4
Bariumhydroxid Svávulsýra Vatn Bariumsulfat
H
+
+ OH
–
→
H
2
O
At nevtralisera og pH-virði
Vit hava fyrr tikið hydrogen-jonir úr sýru við
metali, t.d. magnesium. Tá missir sýran styrkina,
hon verður vandaleys og etsar ikki longur. Tað
nevna vit at nevtralisera sýru.
Einfaldari er at nevtralisera sýru við at blanda
eina basu uppí. Tá reagera hydrogen-jonirnar H
+
í sýruni við hydroxid-jonirnar OH
–
í basuni og
verða til vatn:
Tað ræður sjálvandi um at lata líka nógvar OH
–
-jonir í løgin, sum H
+
-jonir eru í sýruni. Tá
hvørva hesar jonirnar og loysingin verður nevtral
við pH-virði um leið 7.
Tað ber til at fylgja pH-virðinum, meðan nev-
traliseringin fer fram. So hvørt basa verður stoytt
í sýruna, hækkar pH. Tá ið virðið er komið upp á
7, er løgurin nevtralur.
H
+
+ OH
–
→
H
2
O
Her kanna vit, hvat
verður av hinum
jonunum í loysingini.


